Molekulaarbioloogia tehnoloogia pideva arenguga on geenimutatsioonide ning defektide ja haiguste vahelised seosed saavutanud üha põhjalikuma arusaamise.Nukleiinhapped on äratanud palju tähelepanu, kuna neil on suur kasutusvõimalus haiguste diagnoosimisel ja ravis.Nukleiinhapperavimid viitavad kunstlikult sünteesitud DNA või RNA fragmentidele, millel on haigusravi funktsioonid.Sellised ravimid võivad otseselt mõjuda haigusi põhjustavatele sihtgeenidele või haigust põhjustavatele sihtmärk-mRNA-dele ja mängida rolli haiguste ravis geeni tasemel.Võrreldes traditsiooniliste väikesemolekuliliste ravimite ja antikeharavimitega võivad nukleiinhapperavimid reguleerida haigust põhjustavate geenide ekspressiooni juurtest ning neil on "sümptomite ravimine ja algpõhjuse ravimine".Nukleiinhapperavimitel on ka ilmsed eelised, nagu kõrge efektiivsus, madal toksilisus ja kõrge spetsiifilisus.Alates esimese nukleiinhapperavimi fomivirseennaatriumi turule toomisest 1998. aastal on paljud nukleiinhapperavimid heaks kiidetud kliiniliseks raviks.
Praegu ülemaailmselt turul olevad nukleiinhapperavimid hõlmavad peamiselt antisenss-nukleiinhapet (ASO), väikest segavat RNA-d (siRNA) ja nukleiinhappe aptameere.Välja arvatud nukleiinhappe aptameerid (mis võivad ületada 30 nukleotiidi), on nukleiinhapperavimid tavaliselt 12–30 nukleotiidist koosnevad oligonukleotiidid, mida tuntakse ka oligonukleotiidi ravimitena.Lisaks on miRNA-d, ribosüümid ja desoksüribosüümid näidanud suurt arenguväärtust erinevate haiguste ravis.Nukleiinhapperavimitest on tänapäeval saanud üks lootustandvamaid valdkondi biomeditsiini uurimis- ja arendustegevuses.
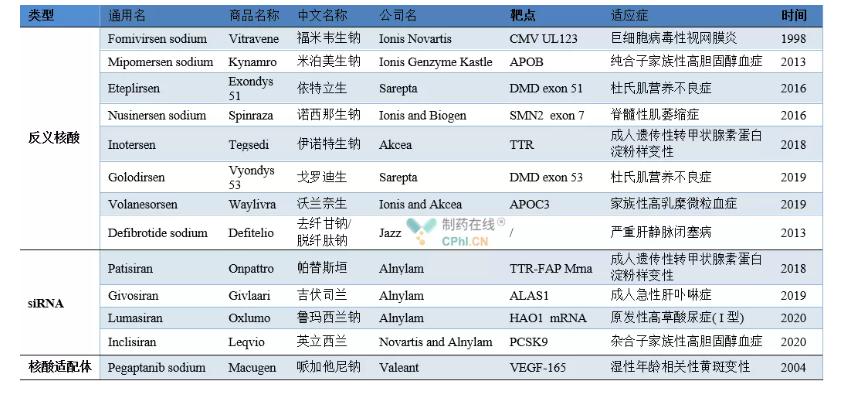
Heakskiidetud nukleiinhapperavimite näited
Antisenss-nukleiinhape
Antisenss-tehnoloogia on uus ravimiarendustehnoloogia, mis põhineb Watson-Cricki baasi komplementatsiooni põhimõttel, kasutades sihtgeenide ekspressiooni spetsiifiliseks reguleerimiseks organismi kunstlikult sünteesitud või sünteesitud spetsiifilisi komplementaarseid DNA või RNA fragmente.Antisenss-nukleiinhappel on siht-RNA-ga komplementaarne alusjärjestus ja see võib sellega spetsiifiliselt seonduda.Antisenss-nukleiinhapped hõlmavad üldiselt antisenss-DNA-d, antisenss-RNA-d ja ribosüüme.Nende hulgas on antisenss-DNA kõrge stabiilsuse ja madala maksumuse tõttu antisenss-DNA-l domineeriv positsioon praeguses antisenss-nukleiinhapperavimite uurimises ja rakendamises.
Fomivirsennaatriumi (kaubanimi Vitravene) töötas välja Ionis Novartis.1998. aasta augustis kiitis FDA selle heaks tsütomegaloviiruse retiniidi raviks immuunpuudulikkusega patsientidel (peamiselt AIDS-iga patsientidel), saades esimeseks turustatavaks nukleiinhapperavimiks.Fomivirseen inhibeerib CMV osalist valguekspressiooni, seondudes spetsiifilise mRNA-ga (IE2), reguleerides seeläbi viiruse geenide ekspressiooni terapeutilise toime saavutamiseks.Seoses aga patsientide arvu oluliselt vähendanud ülitõhusa retroviirusevastase ravi esilekerkimisega tühistas Novartis 2002. ja 2006. aastal Fomivirseni ravimite müügiloa vastavalt Euroopas ja Ameerika Ühendriikides ning toote müük on peatatud.
Mipomerseni naatrium (kaubandusnimi Kynamro) on ASO ravim, mille on välja töötanud Prantsuse firma Genzyme.2013. aasta jaanuaris kiitis FDA selle heaks homosügootse perekondliku hüperkolesteroleemia raviks.Mipomersen inhibeerib ApoB-100 valgu (apolipoproteiini) ekspressiooni, seondudes ApoB-100mRNA-ga, vähendades seeläbi oluliselt inimese madala tihedusega lipoproteiinide kolesterooli, madala tihedusega lipoproteiinide ja muid näitajaid, kuid kõrvalmõjude, nagu maksatoksilisuse tõttu, 13. detsember 2012 lükkas samal päeval müügiloa ka EMA taotluse.
2016. aasta septembris kiitis FDA heaks Eteplirseni (kaubanimi Exon 51), mille Sarepta töötas Duchenne'i lihasdüstroofia (DMD) raviks.DMD-ga patsiendid ei saa normaalselt ekspresseerida funktsionaalset antiatroofset valku DMD geeni mutatsioonide tõttu organismis.Eteplirsen seondub spetsiifiliselt valgu pre-messenger RNA (Pre-mRNA) eksoniga 51, eemaldab eksoni 51 ja taastab mõned allavoolu geenid. Tavaline ekspressioon, transkriptsioon ja translatsioon, et saada osa düstrofiinist, et saavutada ravitoime.
Nusinersen on Spinraza poolt spinaalse lihasatroofia raviks välja töötatud ASO ravim, mille FDA kiitis heaks 23. detsembril 2016. 2018. aastal kiitis FDA heaks Tegsedi poolt välja töötatud Inotesen täiskasvanute päriliku transtüretiini amüloidoosi raviks.2019. aastal kiitis FDA heaks Golodirseni, mille Sarepta töötas välja Duchenne'i lihasdüstroofia raviks.Sellel on sama toimemehhanism nagu Eteplirsenil ja selle toimekohaks saab ekson 53. Samal aastal sai Euroopa Ravimiamet (EMA) heakskiidu Ionisand Akcea poolt ühiselt välja töötatud perekondliku hüperkülomikroneemia raviks.Volanesorsen reguleerib triglütseriidide metabolismi, inhibeerides apolipoproteiin C-Ⅲ tootmist, kuid sellel on ka kõrvaltoime, mis vähendab trombotsüütide taset.
Defibrotiid on plasmiini omadustega oligonukleotiidide segu, mille on välja töötanud Jazz.See sisaldab 90% DNA üheahelalist DNA-d ja 10% kaheahelalist DNA-d.EMA kiitis selle heaks 2013. aastal ja seejärel kiitis selle heaks FDA raskete maksaveenide raviks.Oklusiivne haigus.Terapeutilise toime saavutamiseks võib defibrotiid suurendada plasmiini aktiivsust, suurendada plasminogeeni aktivaatorit, soodustada trombomoduliini ülesreguleerimist ning vähendada von Willebrandi faktori ja plasminogeeni aktivaatori inhibiitorite ekspressiooni.
siRNA
siRNA on spetsiifilise pikkuse ja järjestusega väike RNA fragment, mis saadakse siht-RNA lõikamisel.Need siRNA-d võivad spetsiifiliselt esile kutsuda sihtmärk-mRNA lagunemise ja saavutada geeni vaigistava efekti.Võrreldes keemiliste väikesemolekuliliste ravimitega on siRNA ravimite geeni vaigistav toime kõrge spetsiifilisuse ja efektiivsusega.
11. augustil 2018 kiitis FDA heaks esimese siRNA ravimi patisiran (kaubanimi Onpattro) ja see toodi ametlikult turule.See on üks peamisi verstaposte RNA interferentsi tehnoloogia arengu ajaloos.Patisirani töötasid ühiselt välja Alnylam ja Sanofi tütarettevõte Genzyme.See on siRNA ravim päriliku türoksiini poolt vahendatud amüloidoosi raviks.2019. aastal kiitis FDA heaks givosiraani (kaubanimi Givlaari) teise siRNA ravimina ägeda maksaporfüüria raviks täiskasvanutel.2020. aastal töötas Alnylam välja esmase I tüüpi ravimi laste ja täiskasvanute raviks.FDA kiitis heaks kõrge oksaluuriaga lumasiraani.2020. aasta detsembris kiitis EMA heaks Inclisiran, mille Novartis ja Alnylam arendasid ühiselt täiskasvanute hüperkolesteroleemia või segatüüpi düslipideemia raviks.
Aptamer
Nukleiinhappe aptameerid on oligonukleotiidid, mis võivad seonduda mitmesuguste sihtmolekulidega, nagu väikesed orgaanilised molekulid, DNA, RNA, polüpeptiidid või kõrge afiinsuse ja spetsiifilisusega valgud.Võrreldes antikehadega on nukleiinhappe aptameeridel lihtne süntees, madalam hind ja lai valik sihtmärke ning neil on laiem potentsiaal ravimite kasutamiseks haiguste diagnoosimisel, ravil ja ennetamisel.
Pegaptaniib on esimene nukleiinhappe aptameeri ravim, mille Valeant töötas välja märja vanusega seotud kollatähni degeneratsiooni raviks ja mille FDA kiitis heaks 2004. aastal. Seejärel kiideti EMA ja PMDA heaks 2006. aasta jaanuaris ja 2008. aasta juulis ning see tuli turule.Terapeutilise toime saavutamiseks inhibeerib pegaptaniib angiogeneesi ruumilise struktuuri ja vaskulaarse endoteeli kasvufaktori kombinatsiooni kaudu.Sellest ajast alates on see sarnaste ravimitega Lucentis konkureerinud ja selle turuosa on palju langenud.
Nukleiinhapperavimid on muutunud kliiniliste ravimite ja uute ravimite turul kuumaks kohaks tänu oma märkimisväärsele ravitoimele ja lühikesele arendustsüklile.Kuna tegemist on uue ravimiga, seisab see silmitsi väljakutsetega, samas seistes silmitsi võimalustega.Tänu oma eksogeensetele omadustele on nukleiinhapete spetsiifilisus, stabiilsus ja efektiivne kohaletoimetamine muutunud peamisteks kriteeriumiteks otsustamaks, kas oligonukleotiididest võivad saada väga tõhusad nukleiinhapperavimid.Sihtmärgiväline toime on alati olnud nukleiinhapperavimite võtmepunkt, mida ei saa eirata.Nukleiinhapperavimid võivad aga mõjutada haigust põhjustavate geenide ekspressiooni juurtest ja saavutada järjestuse spetsiifilisus ühe aluse tasemel, millel on „alguse põhjuse ja sümptomite ravimise” omadused.Üha enamate haiguste varieeruvust silmas pidades saab püsivaid tulemusi saavutada vaid geneetiline ravi.Seotud tehnoloogiate pideva täiustamise, täiustamise ja arenguga käivitavad nukleiinhapperavimid, mida esindavad antisenss-nukleiinhapped, siRNA ja nukleiinhappe aptameerid, kindlasti uue laine haiguste ravis ja farmaatsiatööstuses.
Rviited:
[1] Liu Shaojin, Feng Xuejiao, Wang Junshu, Xiao Zhengqiang, Cheng Pingsheng.Nukleiinhapperavimite turuanalüüs minu riigis ja vastumeetmed[J].Chinese Journal of Biological Engineering, 2021, 41(07): 99–109.
[2] Chen Wenfei, Wu Fuhua, Zhang Zhirong, Sun Xun.Teadustöö edusammud turustatavate nukleiinhapperavimite farmakoloogias[J].Chinese Journal of Pharmaceuticals, 2020, 51(12): 1487–1496.
[3] Wang Jun, Wang Lan, Lu Jiazhen, Huang Zhen.Turustatavate nukleiinhapperavimite efektiivsuse ja uuringute edenemise analüüs[J].Chinese Journal of New Drugs, 2019, 28(18): 2217–2224.
Teave autori kohta: Sha Luo, Hiina meditsiini uurimis- ja arendustöötaja, töötab praegu suures kodumaises ravimite uurimis- ja arendusettevõttes ning on pühendunud uute Hiina ravimite uurimisele ja arendamisele.
Seotud tooted:
Postitusaeg: 19.11.2021