Ⅰ. Suurendage reaktsioonisüsteemi tundlikkust:
1. Eraldage kvaliteetne RNA:
Edukas cDNA süntees pärineb kvaliteetsest RNA-st.Kvaliteetne RNA peaks tagama vähemalt kogu pikema ja ei sisalda inhibiitoreid, mis ei sisalda registreerivaid ensüüme, nagu EDTA või SDS.RNA kvaliteet määrab järjestusteabe maksimaalse väärtuse, mida saate cDNA-sse transkribeerida.Üldine RNA puhastamise meetod on isootsüanaadi/atsidofenooli kasutamise etapiviisiline meetod.RNaasi saastumise vältimiseks vajab RNaasi rikkast proovist (näiteks pankreasest) eraldatud RNA kvaliteetse RNA säästmiseks formaldehüüdi säilitamist, mis veelgi enam pikaajaliseks säilitamiseks.Roti maksast ekstraheeritud RNA lagunes põhimõtteliselt pärast ühenädalast vees hoidmist, samas kui roti põrnast eraldatud RNA püsis stabiilsena pärast kolmeaastast vees hoidmist.Lisaks on transkriptid, mis on suuremad kui 4 kb, tundlikumad RNaasi degradatsiooni jälgimise suhtes kui väikesed transkriptid.Säilitus-RNA proovi stabiilsuse suurendamiseks võib RNA lahustada ioonide metamamiinis ja säilitada -70 °C.RNA päästmiseks kasutatav tüliid ei tohi sisaldada mitmesuguseid RNA-d lagundavaid objekte.Kõhunäärmest pärinevat RNA-d saab metalmamiinis säilitada vähemalt ühe aasta.Kui olete RNA kasutamiseks valmis, võite RNA sadestamiseks kasutada järgmisi meetodeid: lisage NaCl 0,2 m ja 4-kordsele etanooli mahule, asetage 3–5 minutiks toatemperatuurile ja 5 minutiks 10 000 × g tsentrifugaali.
2. Kasutage pöördtranskriptaasi ilma RNaseH aktiivsuseta (RNaseH-)
Sageli lisatakse pöördtranskriptsioonireaktsioonidele RNaasi inhibiitoreid, et suurendada cDNA sünteesi pikkust ja saagist.RNaasi inhibiitor lisatakse esimeses ahelsünteesireaktsioonis puhvrite ja redutseerivate ainete, nagu DTT, juuresolekul, kuna cDNA-eelne sünteesiprotsess denatureerib inhibiitori, vabastades sellega seotud RNA-d, mis lagundavad RNA-d.Valgu RNaasi inhibiitor takistab ainult RNA lagunemist RNaasi A, B, C poolt ega takista RNaasi teket nahal, seega tuleb olla ettevaatlik, et vaatamata nende inhibiitorite kasutamisele ei satuks RNaasi sõrmedest.
Pöördtranskriptaas katalüüsib RNA konversiooni cDNA-ks.Nii M-MLV kui ka AMV omavad endogeenset RNaasH aktiivsust lisaks nende enda polümeraasi aktiivsusele.RNaasH aktiivsus konkureerib polümeraasi aktiivsusega heterosügootsete ahelate pärast, mis moodustuvad RNA matriitsi ja DNA praimerite või cDNA pikendusahelate vahel, ning lagundab RNA: RNA ahelaid DNA kompleksides.RNaasH aktiivsusega lagunenud RNA matriitse ei saa enam kasutada cDNA sünteesi tõhusate substraatidena, mis vähendab cDNA sünteesi saagist ja pikkust.Seega oleks pöördtranskriptaasi RNaasH aktiivsuse kõrvaldamine või märkimisväärne vähendamine väga kasulik.
SuperScriptⅡ pöördtranskriptaas, RNaseH-i MMLV pöördtranskriptaas ja thermoScript pöördtranskriptaas, RNaseH-i AMV andsid rohkem täispika cDNA-d kui MMLV ja AMV.RT-PCR tundlikkust mõjutab sünteesitud cDNA kogus.ThermoScript on palju tundlikum kui AMV.RT-PCR produktide suurust piirab pöördtranskriptaasi võime cDNA-d sünteesida, eriti suuremate Cdnade kloonimisel.Võrreldes MMLV-ga suurendas SuperScripⅡ märkimisväärselt pikkade RT-PCR toodete saagist.RNaseH- pöördtranskriptaas suurendab ka termilist stabiilsust, nii et reaktsiooni saab läbi viia normaalsest kõrgemal temperatuuril 37-42 ℃.Soovitatud sünteesitingimustes kasutati oligo (dT) praimereid ja 10 μCi [alfa-p] dCTP.Esimese ahela kogutoodang arvutati TCA sadestamise meetodil.Täispikka cDNA-d analüüsiti, kasutades suuruse järgi sorteeritud riba eemaldamist ja loendamist aluselises agaroosgeelis.
3. Suurendage pöördtranskriptsiooni soojuse säilimise temperatuuri:
Kõrgem säilitustemperatuur aitab avada RNA sekundaarset struktuuri ja tõsta reaktsiooni saagist.Enamiku RNA mallide puhul kõrvaldab RNA ja praimeri hoidmine 65 °C juures ilma puhvri või soolata ning seejärel kiiresti jääl jahutades enamiku sekundaarstruktuure ja võimaldab praimeritel seonduda.Mõnel mallil on siiski sekundaarne struktuur, isegi pärast termilist denatureerimist.Neid keerulisi malle saab amplifitseerida, kasutades ThermoScripti pöördtranskriptaasi ja asetades amplifikatsiooni parandamiseks pöördtranskriptaasi reaktsiooni kõrgemale temperatuurile.Kõrgem säilitustemperatuur võib samuti suurendada spetsiifilisust, eriti kui cDNA süntees toimub geenispetsiifiliste praimerite (GSPS) abil (vt 3. peatükk).Kui kasutate GSP-d, veenduge, et praimeri Tm väärtus oleks sama, mis eeldatav säilitustemperatuur.Ärge kasutage oligo(dT) ja juhuslikke praimereid temperatuuril üle 60 ℃.Juhuslikke praimereid tuleb hoida temperatuuril 25 ℃ 10 minutit enne temperatuuri tõstmist 60 ℃-ni.Lisaks kõrgemate pöördtranskriptsiooni temperatuuride kasutamisele saab spetsiifilisust parandada RNA/praimeri segu otse ülekandmisega 65 ℃ denatureerimistemperatuurilt pöördtranskriptsiooni hoidmistemperatuurile ja eelkuumutatud 2x reaktsioonisegu lisamisega (cDNA termilise initsiatsiooni süntees).See lähenemisviis aitab vältida molekulidevahelist aluste paaristumist, mis toimub madalamatel temperatuuridel.PCR-instrumendi kasutamine lihtsustab paljusid RT-PCR-i jaoks vajalikke temperatuurilüliteid.
Tth kuumstabiliseeritud polümeraas toimib Mg2+ juuresolekul DNA polümeraasina ja Mn2+ juuresolekul RNA polümeraas.See suudab hoida soojust kuni 65 ℃.Kuid Mn2+ olemasolu PCR-i ajal vähendab täpsust, mis muudab Tth polümeraasi vähem sobivaks suure täpsusega amplifikatsiooniks, näiteks cDNA kloonimiseks.Lisaks on Tth pöördtranskriptsioonil vähem efektiivne, mis vähendab tundlikkust, ja kuna üks ensüüm võib teostada pöördtranskriptsiooni ja PCR-i, ei saa ilma pöördtranskriptsioonita kontrollreaktsioone kasutada cDNA amplifitseeritud produktide eristamiseks saastunud genoomse DNA omadest.
4. Lisand, mis soodustab pöördtranskriptsiooni:
Lisandite, sealhulgas glütseriini ja DMSO lisamine esimesele ahelsünteesireaktsioonile võib vähendada nukleiinhappe kaksikahela stabiilsust ja lahti kerida RNA sekundaarstruktuuri.Lisada võib kuni 20% glütseriini või 10% DMSO-d, ilma et see mõjutaks SuperScriptⅡ või MMLV aktiivsust.AMV talub ka kuni 20% glütserooli aktiivsust vähendamata.RT-PCR tundlikkuse maksimeerimiseks SuperScriptⅡ pöördtranskriptsiooni reaktsioonis võib lisada 10% glütserooli ja isoleerida 45 ℃ juures.Kui PCR-ile lisada 1/10 retrotranskriptsiooni-reaktsiooni produktist, on glütserooli kontsentratsioon amplifikatsioonireaktsioonis 0,4%, mis ei ole PCR inhibeerimiseks piisav.
5. RNaseH töötlemine:
Tundlikkust saab parandada, kui enne PCR-i töödelda cDNA sünteesireaktsioone RNaasH-ga.Mõnede mallide puhul arvatakse, et RNA cDNA sünteesireaktsioonis takistab amplifitseeritud produktide seondumist, sel juhul võib ravi RNaasH-ga suurendada tundlikkust.Üldiselt on ravi RNaasH-ga vajalik suhteliselt pika täispika cDNA sihtmatriitsi, näiteks madala koopiaga tuberoosscheroosⅡ amplifitseerimiseks.Selle keerulise malli jaoks võimendas RNaseH SuperScriptⅡ või AMV sünteesitud cDNA genereeritud signaali.Enamiku RT-PCR reaktsioonide puhul on RNaasH töötlemine valikuline, kuna 95 ℃ isoleeritud PCR denaturatsioonietapp hüdrolüüsib tavaliselt RNA RNA: DNA kompleksist.
6. Täiustatud meetodid väikeste RNA koguste tuvastamiseks:
RT-PCR on eriti keeruline, kui saadaval on ainult väikesed kogused RNA-d.Glükogeeni lisamine kandjana RNA eraldamisel aitab suurendada väikeste proovide saagist.Trizoliga samal ajal võib lisada RNaasivaba glükogeeni.Glükogeen on vees lahustuv ja võib jääda veefaasi koos RNA-ga, et aidata järgneval sadenemisel.RNaasivaba glükogeeni soovitatav kontsentratsioon on 250 μg/ml proovide puhul, mis sisaldavad alla 50 mg koe või 106 kultiveeritud rakku.
Atsetüülitud BSA lisamine pöördtranskriptsioonireaktsioonidele SuperScriptⅡ abil võib suurendada tundlikkust ning väikeste RNA koguste korral võib SuperScriptⅡ koguse vähendamine ja 40 ühiku RnaseOut nukleaasi inhibiitori lisamine parandada tuvastamise taset.Kui RNA eraldamisel kasutatakse glükogeeni, on SuperScriptⅡ abil pöördtranskriptsioonireaktsioonidele siiski soovitatav lisada BSA või RNaasi inhibiitoreid.
Ⅱ. Suurendage RT-PCR spetsiifilisust
1. cNDA süntees:
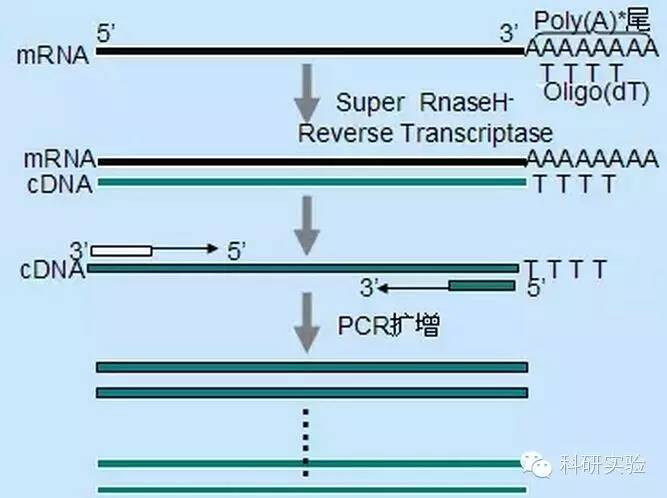
Esimese ahela cDNA sünteesi algatamiseks saab kasutada kolme erinevat meetodit ning iga meetodi suhteline spetsiifilisus mõjutab sünteesitava cDNA kogust ja tüüpi.
Juhusliku praimeri meetod on kolmest meetodist kõige vähem spetsiifiline.Praimerid anniilitakse mitmes kohas kogu transkripti jooksul, et saada lühike, osalise pikkusega cDNA.Seda meetodit kasutatakse sageli 5'-terminaalsete järjestuste ja cDNA saamiseks RNA matriitsidest, millel on sekundaarsed struktuursed piirkonnad või terminatsioonisaidid, mida pöördtranskriptaas ei suuda replitseerida.Pikima cDNA saamiseks tuleb empiiriliselt määrata praimerite ja RNA suhe igas RNA proovis.Juhuslike praimerite algkontsentratsioon on vahemikus 50 kuni 250 ng 20 μl reaktsioonisüsteemi kohta.Kuna kogu RNA-st juhuslike praimerite abil sünteesitud cDNA on peamiselt ribosomaalne RNA, valitakse matriitsiks üldiselt polü(A)+RNA.
Oligo(dT) initsiatsioon on spetsiifilisem kui juhuslikud praimerid.See hübridiseerub polü(A) sabaga, mida leidub enamikus eukarüootsetes rakkudes mRNA 3'-otsas.Kuna polü(A)+RNA on ligikaudu 1% kuni 2% kogu RNA-st, on cDNA kogus ja keerukus palju väiksem kui juhuslike praimerite kasutamisel.Oma kõrge spetsiifilisuse tõttu ei vaja oligo(dT) üldiselt optimeerimist RNA ja praimeri suhte ja polü(A)+ valiku jaoks.Soovitatav on kasutada 0,5 μg oligo(dT) 20 μl reaktsioonisüsteemi kohta.oligo(dT)12-18 sobib enamiku RT-PCR jaoks.ThermoScript RT-PCR süsteem pakub oligo(dT)20 tänu oma heale termilisele stabiilsusele ja sobib kõrgemate hoidmistemperatuuride jaoks.
Geenispetsiifilised praimerid (GSP) on parimad spetsiifilised praimerid pöördtranskriptsiooni etapis.GSP on antisenss-oligonukleosiid, mis võib spetsiifiliselt hübridiseeruda RNA sihtjärjestustega, selle asemel, et anniilida kõiki RNA-sid nagu juhuslikud praimerid või oligo(dT).PCR praimerite kujundamisel kasutatud reeglid kehtivad ka pöördtranskriptsioonireaktsiooni GSP kavandamisel.GSP võib olla sama järjestus kui mRNA3' otsas anniilitud amplifikatsioonipraimer või GSP võib olla konstrueeritud nii, et see anniilitakse pöördamplifikatsioonipraimeriga allavoolu.Mõnede amplifitseeritud objektide jaoks on edukaks RT-PCR-ks vaja kavandada rohkem kui üks antisenss-praimer, kuna sihtmärk-RNA sekundaarne struktuur võib takistada praimeri seondumist.Esimeses ahelsünteesi reaktsioonisüsteemis 20 μl soovitatakse kasutada 1 pmol antisenss GSP-d.
2. Suurendage pöördtranskriptsiooni soojuse säilivustemperatuuri:
GSP spetsiifilisuse täielikuks ärakasutamiseks tuleks kasutada kõrge termilise stabiilsusega pöördtranskriptaasi.Kuumusstabiilset pöördtranskriptaasi saab isoleerida kõrgematel temperatuuridel, et suurendada reaktsiooni raskust.Näiteks kui GSP lõõmutatakse temperatuuril 55 °C, ei kasutata GSP spetsiifilisust täielikult ära, kui pöördtranskriptsioon viiakse läbi 37 °C juures madala rangusega, kasutades AMV või M-MLV.SuperScripⅡ ja ThermoScript võivad aga reageerida temperatuuril 50 ℃ või kõrgemal, mis välistab madalamatel temperatuuridel toodetud mittespetsiifilised tooted.Maksimaalse spetsiifilisuse tagamiseks võib RNA/praimeri segu viia otse 65 ℃ denatureerimistemperatuurilt pöördtranskriptsiooni hoidmistemperatuurile, lisades eelkuumutatud 2 x reaktsioonisegu (cDNA sünteesi termiline initsiatsioon).See aitab vältida aluste sidumist molekulide vahel madalatel temperatuuridel.PCR-instrumendi kasutamine lihtsustab paljusid RT-PCR-i jaoks vajalikke temperatuurimuutusi.
3. Vähendage genoomse DNA saastumist:
Üks võimalik raskus RT-PCR-ga on see, et RNA saastab genoomset DNA-d.Paremate RNA eraldamismeetodite, nagu Trizol Reagent, kasutamine vähendab genoomse DNA saastumist RNA preparaatides.Genoomsest DNA-st toodetud toodete vältimiseks võib RNA-d töödelda amplifikatsiooniastmega DnasⅠ-ga, et eemaldada saastunud DNA enne pöördtranskriptsiooni.Proove hoiti 10 minutit temperatuuril 65 ℃ 2,0 mM EDTA-s, et lõpetada DNaasiⅠ seedimine.EDTA kelaadib magneesiumioone, et vältida magneesiumioonist sõltuvat RNA hüdrolüüsi, mis toimub kõrgel temperatuuril.
Amplifitseeritud cDNA eraldamiseks genoomi DNA amplifikatsiooniproduktist saab kavandada praimereid, mis anniiluvad eraldatud eksoniga eraldi.cDNA-st pärinevad PCR-produktid on lühemad kui saastunud genoomsest DNA-st pärinevad.Iga RNA matriitsiga tehakse ka kontrollitud katse ilma pöördtranskriptsioonita, et teha kindlaks, kas antud fragment pärineb genoomsest DNA-st või cDNA-st.PCR-produktid, mis on saadud pöördtranskriptsiooni puudumisel, pärinevad genoomist.
Seotud toode
- Üheastmeline komplekt võimaldab pöördtranskriptsiooni ja PCR-i läbi viia samas katseklaasis.See peab lisama ainult matriitsi RNA, spetsiifilised PCR-praimerid ja RNaasivaba ddH2O.
- RNA reaalajas kvantitatiivset analüüsi saab teha kiiresti ja täpselt.
- Komplektis kasutatakse ainulaadset Foregene pöördtranskriptsiooni reaktiivi ja Foregene HotStar Taq DNA polümeraasi kombineerituna ainulaadse reaktsioonisüsteemiga, et tõhusalt parandada amplifikatsiooni efektiivsust ja reaktsiooni spetsiifilisust.
- Optimeeritud reaktsioonisüsteem muudab reaktsiooni kõrgema tuvastamistundlikkuse, tugevama termilise stabiilsuse ja parema tolerantsi.
- Tõhus võimalus eemaldada gDNA, mis võib eemaldada mallist 2 minuti jooksul gDNA.
- Tõhus pöördtranskriptsioonisüsteem, esimese ahela cDNA sünteesi lõpuleviimiseks kulub vaid 15 minutit.
-Keerulised mallid: suure GC-sisaldusega ja keerulise sekundaarse struktuuriga malle saab suure efektiivsusega tagasi pöörata.
-Kõrge tundlikkusega pöördtranskriptsioonisüsteem, pg-taseme mallid võivad saada ka kvaliteetset cDNA-d.
- Pöördtranskriptsioonisüsteemil on kõrge termiline stabiilsus, optimaalne reaktsioonitemperatuur on 42 ℃ ja sellel on endiselt hea pöördtranskriptsiooni jõudlus temperatuuril 50 ℃.
Postitusaeg: 07.03.2023