Uuena laboris ei ole hea töö positiivseid taimi madala konversioonimääraga taimede hulgast välja sõeluda.Esiteks tuleb suurest hulgast proovidest ükshaaval DNA eraldada ja seejärel tuvastatakse võõrgeenid PCR abil.Tulemused on aga sageli tühjad ja triibud, kus on aeg-ajalt mõni üksus, kuid võimatu on kindlaks teha, kas tuvastatakse vastamata või on vale tuvastamine..Kas sellise eksperimentaalse protsessi ja tulemustega silmitsi seismine on väga abitu?Ärge muretsege, vend õpetab teile, kuidas transgeenseid positiivseid taimi lihtsalt ja täpselt välja sõeluda.
Samm 1
Disain tuvastamise praimerid
Määrake tuvastatav endogeenne geen ja eksogeenne geen vastavalt testitavale proovile ja valige praimeri kujundamiseks esinduslik 100–500 bp järjestus.Head praimerid võivad tagada tuvastamistulemuste täpsuse ja lühendada tuvastamisaega (tavaliselt kasutatavaid tuvastuspraimereid vt lisast).
Märkus: vastloodud praimerid peavad optimeerima reaktsioonitingimusi ja kontrollima tuvastamise täpsust, täpsust ja avastamispiiri enne suuremahulist tuvastamist.
2. samm
Disaini katseprotokoll
Positiivne kontroll: kasutage sihtfragmenti sisaldavat puhastatud DNA-d matriitsina, et teha kindlaks, kas PCR reaktsioonisüsteem ja tingimused on normaalsed.
Negatiivne/tühikontroll: kasutage matriitsina DNA matriitsi või ddH2O, mis ei sisalda sihtfragmenti, et tuvastada, kas PCR-süsteemis on saasteallikas.
Sisemine võrdluskontroll: kasutage testitava proovi endogeense geeni praimeri/sondi kombinatsiooni, et hinnata, kas matriitsi saab PCR-ga tuvastada.
Märkus:
Iga katse jaoks tuleks määrata positiivsed, negatiivsed/tühjad kontrollid ja sisekontrollid, et hinnata katsetulemuste paikapidavust.
Eksperimendi ettevalmistamine
Enne kasutamist jälgige, kas lahus on ühtlaselt segunenud.Kui leitakse sadet, tuleb see enne kasutamist lahustada ja segada vastavalt juhistele.2×PCR-segu tuleb enne kasutamist pipeteerida ja korduvalt mikropipetiga segada, et vältida ioonide ebaühtlast jaotumist.
Märkus:
Võtke kasutusjuhend välja ja lugege see hoolikalt läbi ning tehke enne katset ettevalmistusi rangelt vastavalt juhendi nõuetele.
4. samm
Valmistage ette PCR reaktsioonisüsteem
Vastavalt katseprotokollile segage praimerid, H2O ja 2×PCR ühtlaseks, tsentrifuugige ja jagage need igasse reaktsioonituubi.
Märkus:
Suuremahuliseks või pikaajaliseks testimiseks on soovitatav kasutada UNG ensüümi sisaldavat PCR-reaktsioonisüsteemi, mis võimaldab tõhusalt vältida PCR-toodete põhjustatud aerosoolsaastet.
5. samm
Lisa reaktsioonimall
Kasutades Direct PCR tehnoloogiat, ei ole vaja tüütut nukleiinhappepuhastusprotsessi, proovimatriitsi saab valmistada 10 minuti jooksul ja lisada vastava PCR reaktsioonisüsteemi.
Märkus:
Lõhustamismeetodil on parem tuvastamise efekt ja saadud toodet saab kasutada mitmeks tuvastamisreaktsiooniks.
5.1: lehtede otsene paisumine
Vastavalt juhendis oleva pildi suurusele lõigake 2-3mm läbimõõduga lehekude ja asetage see PCR reaktsioonisüsteemi.
Märkus. Veenduge, et lehefragmendid on täielikult PCR reaktsioonilahusesse sukeldatud ja ärge lisage liigset lehekudet.
5.2: Lehtede poolitamise meetod
Lõika 5-7 mm läbimõõduga lehekude ja aseta see tsentrifuugitorusse.Kui valite küpsed lehed, vältige lehe põhiveeni kudede kasutamist.Pipeteerige 50 ul puhver P1 lüsaati tsentrifuugituubi, et lüsaat saaks lehekoe täielikult sukelduda, asetage see termotsüklerisse või metallvanni ja lüüsige 95 °C juures 5–10 minutit.
Lisage 50 ul puhvri P2 neutraliseerimislahust ja segage hästi.Saadud lüsaati saab kasutada matriitsina ja lisada PCR reaktsioonisüsteemi.
Märkus. Matriitsi kogus on 5–10% PCR-süsteemist ja ei tohiks ületada 20% (näiteks 20 μl PCR süsteemis lisage 1–2 μl lüüsilahust, mitte rohkem kui 4 μl).
6. samm
PCR reaktsioon
Pärast PCR-reaktsioonituubi tsentrifuugimist asetatakse see amplifikatsiooniks PCR-seadmesse.
Märkus:
Reaktsioonis kasutatakse amplifikatsiooniks puhastamata matriitsi, seega on amplifikatsioonitsüklite arv 5-10 tsüklit rohkem kui puhastatud DNA matriitsi kasutamisel.
7. samm
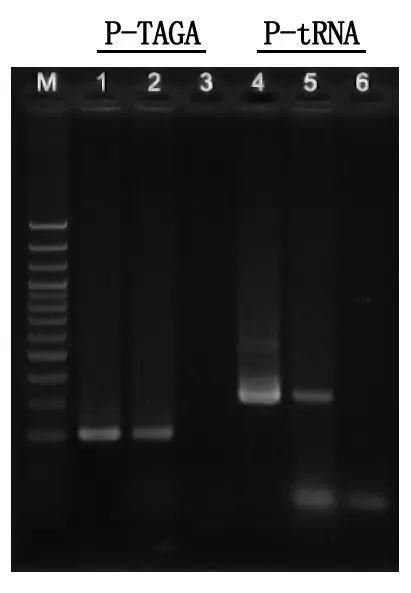
Elektroforeesi tuvastamine ja tulemuste analüüs
M: 100 bp DNA redel
1\4: Puhastatud DNA meetod
2\5: Otsene PCR meetod
3\6: tühi juht
QC:
Katses seatud erinevate kontrollide testitulemused peaksid vastama järgmistele tingimustele.Vastasel juhul tuleks probleemi põhjust analüüsida ja pärast probleemi kõrvaldamist test uuesti läbi viia.
Tabel 1. Erinevate kontrollrühmade normaalsed testitulemused
*Kui plasmiidi kasutatakse positiivse kontrollina, võib endogeense geeni testi tulemus olla negatiivne
Tulemuse otsus:
A. Proovi endogeense geeni testitulemus on negatiivne, mis näitab, et proovist ei saa eraldada tavaliseks PCR-i tuvastamiseks sobivat DNA-d või ekstraheeritud DNA sisaldab PCR-reaktsiooni inhibiitoreid ja DNA tuleks uuesti ekstraheerida.
B. Proovi endogeense geeni testi tulemus on positiivne ja eksogeense geeni testi tulemus negatiivne, mis näitab, et proovist eraldatakse tavaliseks PCR tuvastamiseks sobiv DNA ja võib otsustada, et XXX geeni proovis ei tuvastata.
C. Proovi endogeense geeni testi tulemus on positiivne ja eksogeense geeni testi tulemus on positiivne, mis näitab, et proovist on eraldatud tavaliseks PCR tuvastamiseks sobiv DNA ja proovi DNA sisaldab geeni XXX.Kinnituskatseid saab teha edasi.
8. samm
Disain tuvastamise praimerid
Pärast katset kasutage keskkonnareostuse vältimiseks katseala pühkimiseks 2% naatriumhüpokloriti lahust ja 70% etanoolilahust.
Postitusaeg: 08.09.2021